Взаимодействие газовой атмосферы со сталью при нагреве
Диффузионный процесс взаимодействия между кислородом воздуха и содержащими кислород компонентами газовой атмосферы, с одной стороны, и железом, а также легирующими элементами, с другой стороны, называют окислением стали. Газами, которые не только окисляют, но и обезуглероживают поверхность стали, являются углекислый газ (СО2) и водяной пар (H2O).
Железо с кислородом образуют ряд химических соединений: FeO - закись железа, Fe3O4 - окись-закись железа, Fe2O3 - окись железа. При температурах ниже 570°C образование закиси железа исключено. При окислении железа выше 570°C образуются окислы Fe2O3, Fe3O4, FeO. Слой окалины растет вследствие диффузии железа и легирующих элементов к поверхности металла и встречной диффузии кислорода во внутренние слои металла.
Основными реакциями взаимодействия газов со сталью являются:
2Fe + О2 = 2FeO (1)
3Fe + 2О2 = Fe3O4 (2)
4Fe + ЗО2 = 2Fe2O3 (3)
возможны также реакции:
4FeO + О2 = 2Fe2O3 (4)
4Fe3O4 + О2 = 6Fe2O3 (5)
Взаимодействие водяного пара с железом при температурах ниже 570°С протекает по реакциям:
Н2О + 2Fe3O4 = 3Fe2O3 + Н2 (6)
4H2О + 3Fe <=> Fe3O4 + 4H2 (7)
при температурах выше 570°С - по реакции (6) и дополнительно по реакциям:
Н2О + 3FeO <=> Fe3O4 + H2 (8)
Н2О + Fe <=> FeO + Н2 (9)
Взаимодействие двуокиси углерода с железом при температурах ниже 570°С протекает по реакциям:
СО2 + 2Fe3O4 <=> 3Fe2O3 + СО (10)
4СО2 + 3FeO <=> Fe3O4 + 4CO (11)
при температурах выше 570°С - по реакции (10) и дополнительно по реакциям:
СО2 + 3FeO <=> Fe3O4 + СО (12)
СО2 + Fe <=> FeO + СО (13)
Реакция взаимодействия железа с водяным паром (H2О) сопровождается выделением тепла, т.е. является экзотермической. Реакция взаимодействия двуокиси углерода с железом сопровождается поглощением тепла, т.е. является эндотермической.
На рисунке 1 приведены теоретические кривые равновесия реакций окисления - восстановления железа с двуокисью и окисью углерода и водяным паром и водородом.
Кривые 1 и 2 (рисунок 1) представлены так, что в левой части от кривых расположены области восстановления железа, а в правой части - области окисления железа.
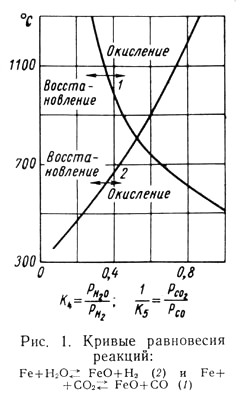 Окислительная способность двуокиси углерода с понижением температуры уменьшается, а с повышением температуры увеличивается (рисунок 1, кривая 1). При температуре ниже 500°C двуокись углерода не может окислять железо. Константа равновесия, представляющая отношение парциальных давлений двуокиси углерода к окиси углерода, изменяется от 0.27 до единицы при снижении температуры газовой атмосферы с 1300 до 500°С. Окислительная способность водяных паров с понижением температуры увеличивается, а с повышением температуры уменьшается (рисунок 1, кривая 2). Константа равновесия, представляющая отношение парциальных давлений водяного пара к водороду, при снижении температуры с 1300 до 370°C изменяется от 0.85 до 0.07.
Окислительная способность двуокиси углерода с понижением температуры уменьшается, а с повышением температуры увеличивается (рисунок 1, кривая 1). При температуре ниже 500°C двуокись углерода не может окислять железо. Константа равновесия, представляющая отношение парциальных давлений двуокиси углерода к окиси углерода, изменяется от 0.27 до единицы при снижении температуры газовой атмосферы с 1300 до 500°С. Окислительная способность водяных паров с понижением температуры увеличивается, а с повышением температуры уменьшается (рисунок 1, кривая 2). Константа равновесия, представляющая отношение парциальных давлений водяного пара к водороду, при снижении температуры с 1300 до 370°C изменяется от 0.85 до 0.07.
В сложной газовой атмосфере имеющей в своем составе окись углерода, двуокись углерода, водород и водяной пар, протекают реакции:
CO + Н2 <=> C + Н2О (14)
СО + Н2О <=> СО2 + Н2 (15)
Для безокислительного нагрева необходимо иметь отношение газов-окислителей в защитной атмосфере (в объемных процентах) во всём интервале рабочих температур в соответствии с кривыми равновесия, представленными на рисунке 1.
Большое влияние на степень окисления железа оказывает присутствие в контролируемой атмосфере сернистых соединений SO2 и H2S. Если содержание SO2 в контролируемой атмосфере увеличивается от 0.1 до 0.5%, то окислительная способность этой атмосферы увеличивается примерно в 3 раза. SO2 и H2S понижают точку плавления окалины железа, вследствие чего оплавляющаяся окалина обнажает все новые слои металла, что сильно увеличивает потери металла. Необходимо тщательно очищать контролируемые атмосферы от SO2 и H2S и не допускать их остаточного содержания в газе свыше 0.005%.
Помимо окисления, стальные детали могут науглероживаться или обезуглероживаться. Обезуглероживание стали - это диффузионный процесс взаимодействия кислорода воздуха или кислородсодержащих компонентов газовой среды с углеродом стали, приводящий к частичному или полному удалению углерода из поверхностных слоев стали.
Диффузионный процесс, при котором поверхностные слои стали насыщаются углеродом, является науглероживанием или цементацией. Этот процесс протекает в три этапа:
-
диффузия молекул цементующего газа к поверхности стальных деталей;
-
химический процесс адсорбции аустенитом углеродсодержащих молекул с образованием атомов углерода в результате диссоциации молекул CO и CH4 при температурах выше верхней критической точки;
-
дальнейшая диффузия атомов углерода в глубинные слои стали.
При цементации имеют место следующие реакции:
2СО <=> С(Fey)+СО2 (16)
СН4 <=> С(Fey) + 2Н2 (17)
При насыщении углеродом у-твердого раствора железа - аустенита сверх предела растворимости протекают реакции с образованием карбида железа - цементита:
3Fe + 2CO <=> Fe3C + CO2 (18)
3Fe+ СН4 <=> Fe3C + 2Н2 (19)
3Fe + СО + Н2 <=> Fe3C + Н2О (20)
 Одновременно в газовой атмосфере могут протекать реакции с образованием углерода (сажи).
Одновременно в газовой атмосфере могут протекать реакции с образованием углерода (сажи).
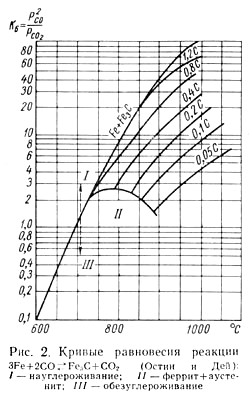
На рисунке 2 показаны типичные теоретические равновесные кривые реакции (18) для углеродистых сталей с различным содержанием углерода.
Если известны температура нагрева стали и заданная концентрация углерода, то по кривым равновесия можно найти соответствующую точку на оси ординат, по которой определяется константа равновесия и вычислить процентное содержание окиси и двуокиси углерода в равновесной газовой атмосфере.
При анализе взаимодействия по реакции (19) необходимо учитывать, что диффузия углерода в железо, при взаимодействии метана с железом, протекает активнее, чем окиси углерода с железом по реакции (18). Активность метана по сравнению с активностью окиси углерода при взаимодействии их с железом в температурном интервале от 800 до 1100°С возрастает в 8 - 400 раз (таблица 1).
Кроме этого, условия равновесия между газовой фазой и сталью сильно изменяются при различной степени насыщения углеродом аустенита стали. При постоянном значении константы равновесия обезуглероживающая способность атмосферы СО - СО2 увеличивается с повышением температуры, науглероживание железа при этих условиях уменьшается (см. рисунок 2).
Сравнительная степень активности углерода, выделяющегося из окиси углерода и метана при диффузии в железо
|
Температура
цементации, °С
|
Максимальное количество активного углерода, г/м3
|
Соотношение активности газов СН4 / СО
| |
|
из окиси углерода (СО)
|
из метана (СН4)
| ||
|
800
900
1000
1100
|
64,2
13,9
4,3
1,34
|
513
525,6
530,6
532,7
|
8
38
123
400
|